ساختار و خواص فلزات
http://modireqc.com/%D8%B3%D8%A7%D8%AE%D8%AA%D8%A7%D8%B1-%D9%88-%D8%AE%D9%88%D8%A7%D8%B5-%D9%81%D9%84%D8%B2%D8%A7%D8%AA/
ساختار و خواص فلزات
ساختار ماده چگونگی ارتباط بين اتمها، يونها و مولکولهای تشکيل دهنده آن ماده را مشخص میکند.
ساختار بلوری فلزات
در حالت کلی مواد جامد دو نوع ساختار اتمی دارند. يک دسته ساختار کريستالی دارند؛ يعنی آرايش اتمها در ساختمان داخلی آنها براساس يک نظم و الگوی تکرار شونده از واحدهايی به نام سلول واحد میباشد. به عبارت ديگر ساختار مواد دارای شبکه کريستالی با کنار هم قرار گرفتن تعداد بسيار زيادی از سلولهای واحد تشکيل شده است
دسته ديگر مواد جامد آنهايی هستند که دارای نظم مشخصی در ساختار خود نيستند که و در اصطلاح آمورف گفته می شوند.
در اين مواد قرار گرفتن اتمها در کنار يکديگر دارای نظم و ترتیب تقريبا خاصی نیست، مثل: شيشه، و بسياری از مواد سراميکی، پلاستيک و لاستيک به طور معمول دارای ساختار اتمی آمورف هستند.
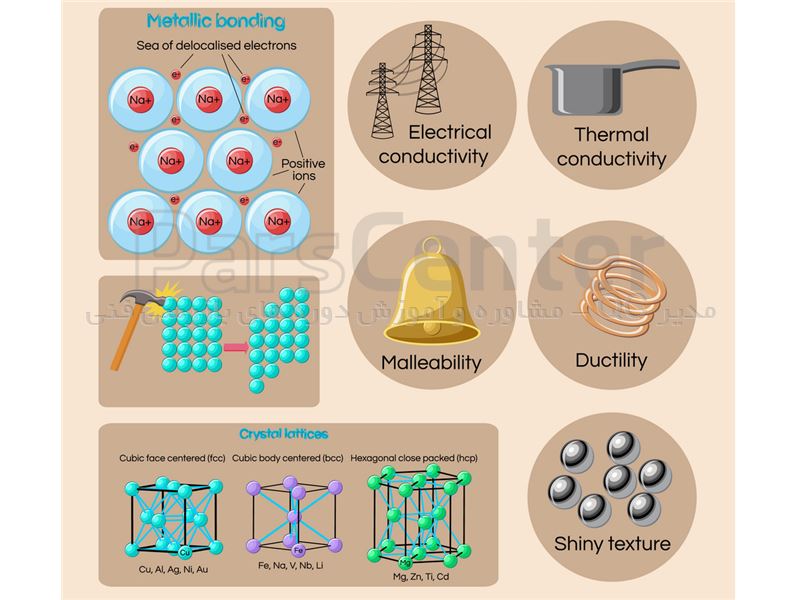
فلزات صنعتی متداول دارای سه نوع نظم اتمی يا شبکه کريستالی هستند:
الف) سلول واحد مکعبی مرکزدار BCC : در اين نوع شبکه بلوری، سلول واحد به صورت يک مکعب فرض میشود که در هر گوشه به اضافه مرکز مکعب يک اتم مستقر میباشد.
بسياری از فلزات نظير: آهن، کرم، تنگستن، واناديم و موليبدن در دمای محيط دارای شبکه بلوری BCC می باشند.ساختار و خواص فلزات – ساختار BCC
ب) سلول واحد مکعبی با وجود مرکز پر FCC
در این نوع شبکه بلوری سلول واحد به صورت يک مکعب در نظر گرفته می شود که هر گوشه و کنار وجوه آن يک اتم قرار دارد.
هر اتم گوشه با هشت سلول واحد مجاور خود مانند شبکه کريستالی BCC مشترک است و هر اتم واقع در مراکز وجوه شش گانه مکعب تنها بين دو سلول واحد مجاور هم مشترک می باشند. به عبارت ديگر حجم اشغال شده در شبکه کريستالی FCC معادل ٧٤ درصد فضای سلول واحد است.
فلزاتی مثل: مس، آلومينيوم، نقره، طلا، پلاتين، نيکل و سرب در دمای معمولی دارای شبکه کريستالی FCC هستند.
ساختار و خواص فلزات – ساختار FCC
ج) سلول واحد منشور با قاعده شش ضلعی فشرده HCP
سلول واحد در این نوع شبکه بلوری، به صورت يک منشور شش وجهی است که دوازده اتم در گوشهها و دو اتم در وسط وجوه بالا و پايين آن قرار گرفته اند. اضافه بر اين سه اتم در وسط صفحات ميانی مستقر میباشند.
بدين ترتيب تعداد اتمهای متعلق به يک سلول واحد HCP در مجموع معادل شش است (يک ششم به ازاء هر يک از اتمهای گوشه، يک دوم به ازاء اتمهای وجوه بالا و پايين و سه اتم متعلق به صفحات ميانی که مختص هر سلول واحد میباشد) و حجم اشغال شده در شبکه کريستالی HCP معادل ٧٤ درصد فضای سلول واحد است.
فلزاتی مثل: روی، منگنز، کادميم، تيتانيوم، کبالت و منيزيم در دمای محيط ساختار بلوری HCP دارند.
ساختار و خواص فلزات – ساختار HCP
ساختار بلوری آهن: ساختار بلوری آهن در دمای پايين به صورت شبکه کريستالی مکعبی مرکز پر (BCC ) است که به آن آهن آلفا میگويند. ولی با افزايش دمای آهن ساختار بلوری آن دچار تغيير میشود.
در دمای ٧٢١ درجه سانتيگراد ساختار آهن دچار تغيير میشود و به شکل مکعبی با وجوه مرکز پر (FCC ) در میآيد که به آن آهن گاما میگويند.
با افزايش بيشتر دمای آهن ، مجددا ساختار کريستالی آن متحول میشود و به حالت BCC تغيير شکل میدهد اين تحول بلوری در دمای ١٢٣٠ درجه سانتيگراد رخ میدهد و در نهايت با افزايش دمای آهن و رسيدن به حد نقطه ذوب (١٥٣٢ درجه سانتيگراد) شبکه بلوری آهن درهم میريزد و به حالت مذاب در میايد.
لازم به ذکر است با تغيير شبکه بلوری آهن نحوه آرايش اتمهای آهن در ساختار آن تغيير میکنند. بنابراين خواص آن دچار تغيير میشود. به طور مثال با تبديل ساختار آهن از حالت BCC به حالت FCC ،حجم آن افزايش پيدا میکند، قابليت هدايت حرارتی و رسانايی الکتريکی آن کم میشود و خاصيت مغناطيسی آهن از بين میرود.(از حالت فرومغناطیس به پارامغناطیس تبدیل می شود).
به طور معمول اکثر فلزات در محدوده دمای محيط تا نقطه ذوب خود دچار يک يا چند تغيير ساختاری میشوند.خواص فلزات
به ندرت ماده ای پيدا می شود که مجموعه ايده آلی از خواص موردنظر را توأم باهم داشته باشد.
به طور مثال کمتر مادهای را میتوان يافت که هم استحکام بالا و هم انعطاف پذيری خوبی داشته باشد.
به طور معمول مواد مستحکم، انعطاف پذيری کمی دارند و برعکس. بنابراين شناخت خواص مواد و تغيير آنها در شرايط مختلف کاری، نکته مهمی است که میبايست به آن توجه شود.
از اينرو آشنايی با خواص فيزيکی، مکانيکی و تکنولوژيکی مواد نقش مهمی در شناسايی و انتخاب مواد به خصوص فلزات و آلياژها که بيشترين کاربرد را در ساخت قطعات و انواع سازه های صنعتی دارند ايفا میکند.
خواص فيزيکی: منظور از خواص فيزيکی خواصی هستند که باعث تغيير در ساختمان شيميايی ماده يا فلز نمیشوند مثل: قابليت هدايت جريان الکتريسيته و حرارت ، جرم مخصوص، نقطه ذوب و امثال آنها.
هدايت الکتريسيته: اين خاصيت عبارت است از قدرت هدايت واحد طول جسم بر واحد سطح مقطع آن که نشاندهنده توانمندی ماده در انتقال بار الکتريکی از يک محل به محل ديگر میباشد.
مواد رسانا مثل فلزات در آخرين مدار الکترونی خود به طور معمول يک يا دو الکترون دارند که قادرند آزادانه از مدار خود خارج شده و در سرتاسر جسم رسانا حرکت کنند.
فلزاتی مثل نقره، مس و آلومينيوم بيشترين هدايت الکتريسيته را دارند. اما در مواد نارسانا مثل پلاستيک و نايلون به دليل عدم وجود الکترونهايی که بتوانند آزادانه در سراسر جسم حرکت داشته باشند، قادر به هدايت جريان الکتريسيته نيستند.
مغناطيسی: همه شما با آهنربا آشنا هستيد. فلزاتی را که جذب آهنربا می شوند فرومغناطيس مینامند.
اين خاصيت مربوط به چگونگی حرکت الکترونها و جهت گيری آنها در ميدان مغناطيسی ناشی می شود و فقط در بعضی فلزات ديده می شود. در حاليکه اغلب آلياژهای آهن (به جز بعضی فولادهای زنگ نزن) و آلياژهای نيکل و کبالت دارای خاصيت مغناطيسی هستند.
ولی غيرفلزات و بسياری از فلزات و آلياژهای آنها دارای چنين خاصيتی نيستند. لذا جذب ميدان مغناطيسی نمیشوند.
هدايت حرارتی: اين خاصيت مشابه هدايت الکتريسيته به صورت قدرت هدايت حرارت واحد طول جسم بر واحد مساحت سطح مقطع آن تعريف میشود و به طور معمول فلزاتی که بيشترين قابليت هدايت الکتريسيته را دارند از نظر هدايت حرارتی نيز بهترين هستند.
انبساط حـرارتی: اتمهای يک مـاده به خصوص فـلزات و آلياژها با دريافت انرژی حرارتی شروع به ارتعاش و لرزش میکنند و فاصله بين اتمها و در نتيجه ابعاد شبکه کريستالی ماده افزايش می يابد. هرچه پيوند بين اتمها در شبکه فلز قویتر باشد (فلزات با دمای ذوب بالا)، ميزان انبساط حرارتی شبکه فلز کمتر است چون اتمها در مقابل حرکت از خود مقاومت نشان میدهند.
ضريب انبساط حرارتی که برحسب واحد طول يا واحد حجم ماده تعريف میشود معياری برای نشان دادن تغييرات ناشی از انبساط حرارتی در مواد میباشد.
جرم مخصوص: جرم واحد حجم از هر ماده را جرم مخصوص آن ماده مینامند. جرم مخصوص به نوع اتمهای تشکيل دهنده ماده، اندازه و تراکم شبکه کريستالی بستگی دارد.
نقطه ذوب: درجه حرارتی که ماده از حالت جامد به حالت مايع تبديل میشود نقطه ذوب ماده میگويند فلزات در حالت خالص نقطه ذوب معينی دارند ولی در صورت اضافه کردن عناصر آلياژی يا آلياژ شدن نقطه ذوب آنها تغيير میکند.
شوک حرارتی
ايجاد ترک در ماده به دليل تنش حرارتی ناشی از تغييرات دمايی شديد را شوک حرارتی میگويند.
تغيير دما سبب ايجاد انبساط و انقباض در ساختار اتمی مواد می شود. چنانچه تغيير دمايی جسم شديد باشد و يا مقدار انبساط يا انقباض زياد باشد سبب ايجاد ترک در ماده میگردد.
مواد مختلف دارای ضريب انبساط حرارتی و قابليت هدايت حرارتی متفاوت می باشند.
از طرفی استحکام يا تنش لازم برای شکست مواد نيز با هم فرق میکند.
بنابراين انبساط و انقباض داخلی ماده در اثر تغيير ناگهانی دما سبب ايجاد ترکهای ريز شده و رشد ترکها موجب شکست میگردد.
قطعات سراميکی و شيشه ای به دليل رسانايی حرارتی پايين، چقرمگی کم و ضريب انبساط حرارتی بالا مستعد اين نوع شکست هستند. در اصطلاح گفته میشود اين مواد در برابر شوک حرارتی حساس میباشند.